Gaz basıncı hacimle nasıl değişir?
Gaz basıncı ve hacmi arasındaki ilişki, gazların davranışını anlamada temel bir rol oynar. Boyle yasası gibi önemli gaz yasaları, bu ilişkiyi ters orantılı biçimde açıklarken, sıcaklık ve moleküler yapı gibi faktörlerin etkisi de göz önünde bulundurulmalıdır.
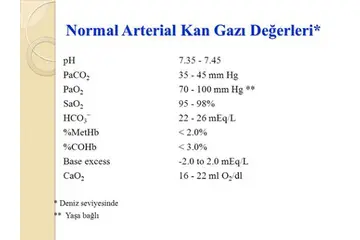
Gaz Basıncı ve Hacim İlişkisi Gaz basıncı ve hacmi arasındaki ilişki, gazların temel özelliklerini anlamak için kritik bir konudur. Bu ilişki, termodinamik ve gaz yasaları çerçevesinde incelenir. 1. Boyle Yasası Boyle yasası, sabit sıcaklık altında bir gazın basıncı ile hacmi arasındaki ters orantılı ilişkiyi tanımlar. Bu yasa, P1V1 = P2V2 formülü ile ifade edilir. Burada:
Bu yasa, gazın hacmi arttığında basıncın düştüğünü, hacmi azaldığında ise basıncın arttığını belirtir. 2. Gazın Moleküler Yapısı Gazlar, moleküllerden oluşur ve bu moleküller arasındaki boşluk, gazın hacmi ile ilişkilidir. Hacim azaldığında, moleküller arasındaki mesafe kısalır ve çarpışma sıklığı artar. Bu, gazın basıncını artırır. 3. Sıcaklık Etkisi Gazın sıcaklığı arttıkça, moleküllerin kinetik enerjisi de artar. Bu da moleküllerin daha hızlı hareket etmesine ve birbirleriyle çarpma sıklığının artmasına neden olur. Bu durumda, gazın basıncı artar. Boyle yasası, sabit sıcaklık koşullarında geçerlidir; ancak sıcaklık değiştikçe, gazın özellikleri de değişir. 4. Uygulamalı Örnekler
Sonuç Gaz basıncı ve hacim arasındaki ilişki, gazların davranışını anlamada önemli bir rol oynar. Boyle yasası gibi temel gaz yasaları, bu ilişkilerin matematiksel açıdan açıklanmasına yardımcı olur. Gazın sıcaklığı, moleküler hareket ve dış etkenler de bu ilişkiyi etkileyen önemli faktörlerdir. Gazların bu özellikleri, çeşitli endüstriyel ve günlük uygulamalarda dikkate alınmalıdır. |
İlk soruyu siz sormak istermisiniz?