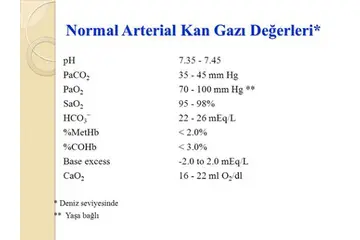
Gazlar konusunda hangi formülleri bilmeliyim?
Gazlar, fiziksel özellikleri ve davranışlarıyla sıklıkla bilimsel araştırmaların odak noktasıdır. Ideal gaz yasası ile başlayarak, yoğunluk, Avogadro, Boyle, Charles ve Gay-Lussac yasaları gibi temel kavramlar, gazların dinamiğini anlamak için kritik rol oynar.
Gazların Temel Özellikleri Gazlar, madde hâllerinden biri olarak düşük yoğunlukları ve yüksek esneklikleri ile bilinirler. Gazların temel özelliklerini anlamak için bazı önemli formüller bulunmaktadır. 1. Ideal Gaz Yasası Ideal gaz yasası, bir gazın basıncı (P), hacmi (V), sıcaklığı (T) ve mol sayısını (n) ilişkilendiren temel bir formüldür. Formülü şöyle ifade edebiliriz:
Burada;
2. Gazın Yoğunluğu Bir gazın yoğunluğunu hesaplamak için ideal gaz yasası kullanılabilir. Aşağıdaki formül ile yoğunluk (d) hesaplanabilir:
Burada;
Burada M, gazın molar kütlesidir. 3. Avogadro Yasası Avogadro yasası, eşit sıcaklık ve basınç altında, eşit hacimlerin eşit mol sayısına sahip olduğunu belirtir. Formülü:
Bu yasa, özellikle gazların mol sayısının hacimle doğru orantılı olduğunu gösterir. 4. Boyle Yasası Boyle yasası, sabit sıcaklıkta bir gazın hacminin basıncı ile ters orantılı olduğunu belirtir. Formülü:
Burada, P ve V sırasıyla basınç ve hacim değerlerini temsil eder. 5. Charles Yasası Charles yasası, sabit basınç altında bir gazın hacminin sıcaklık ile doğru orantılı olduğunu belirtir. Formülü:
Bu formül, hacim ve sıcaklık arasındaki ilişkiyi ortaya koyar. 6. Gay-Lussac Yasası Gay-Lussac yasası, sabit hacimde bir gazın basıncının sıcaklıkla doğru orantılı olduğunu belirtir. Formülü:
Bu formül, basınç ve sıcaklık değişimlerini temsil eder. Sonuç Gazlarla ilgili bu temel formülleri öğrenmek, gazların fiziksel özelliklerini anlamak ve çeşitli hesaplamalar yapmak için son derece önemlidir. Farklı gaz davranışlarının yanı sıra, bu formüller ile gazların etkileşimlerini de anlamış olursunuz. |
İlk soruyu siz sormak istermisiniz?