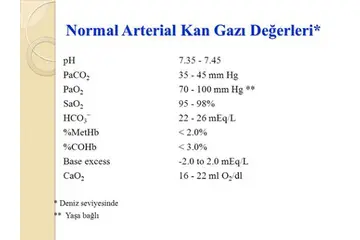
Gazlarda basınç sıcaklık ilişkisi nasıl açıklanır?
Gazların basınç ve sıcaklık arasındaki ilişkisi, gazların fiziksel davranışını anlamak için kritik bir unsurdur. Ideal Gaz Yasası ve Gay-Lussac Yasası gibi temel ilkeler, bu etkileşimi açıklayarak pratik uygulamalarda önemli sonuçlar doğurur. Bu bilgi, otomotivden endüstriyel süreçlere kadar geniş bir yelpazede karşımıza çıkar.
Gazlarda Basınç ve Sıcaklık İlişkisiGazların basınç ve sıcaklık arasındaki ilişki, gazların davranışını anlamak için temel bir unsurdur. Bu ilişki genellikle "Ideal Gaz Yasası" ile açıklanır ve aşağıdaki formülle ifade edilir: Ideal Gaz Yasası PV = nRT - P: Gazın basıncı (Pa veya atm) - V: Gazın hacmi (L veya m³) - n: Gazın mol sayısı - R: Gaz sabiti (8.314 J/mol·K) - T: Gazın mutlak sıcaklığı (Kelvin) Basınç ve Sıcaklık Arasındaki İlişki Gazların sıcaklık ve basınç arasındaki ilişkisi genellikle şu şekilde özetlenebilir:
Gay-Lussac Yasası Bu ilişkiyi daha da derinlemesine incelemek için Gay-Lussac Yasası'na bakabiliriz. Gay-Lussac Yasası, sabit bir hacimdeki gazın basıncının sıcaklığa orantılı olduğunu belirtir. Yani: P1/T1 = P2/T2 Pratik Uygulamalar Gazların basınç ve sıcaklık ilişkisi birçok alanda uygulanmaktadır:
Sonuç Gazlarda basınç ve sıcaklık ilişkisi, gazların davranışlarını anlama ve kontrol etme noktasında kritik bir öneme sahiptir. Ideal Gaz Yasası ve Gay-Lussac Yasası gibi temel yasalar, bu ilişkiyi anlamamıza yardımcı olur. Gazların endüstride ve günlük yaşamda karşılaşılan birçok durumu etkilediği göz önüne alındığında, bu konunun önemi daha da artar. |
İlk soruyu siz sormak istermisiniz?