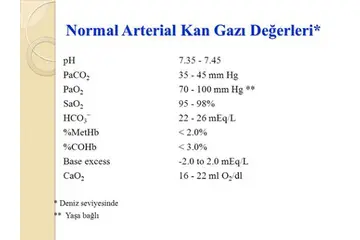
İdeal gazlar yüksek sıcaklıkta nasıl davranır?
İdeal gazlar, birbirleriyle etkileşimde bulunmayan ve hacimleri ihmal edilebilir kabul edilen teorik gazlardır. Yüksek sıcaklıklarda bu gazların davranışları, moleküler hareket, basınç artışı ve hacim değişimleri gibi fiziksel yasalarla açıklanır. İdeal gaz yasası, bu davranışları matematiksel olarak tanımlar. Ancak gerçek gazlar, özellikle aşırı sıcaklık ve basınç koşullarında, ideal davranıştan sapabilir.
İdeal Gazların Tanımı İdeal gazlar, belirli şartlar altında davranışlarını tanımlamak için kullanılan teorik gazlardır. Bu gazlar, moleküllerinin birbirleriyle etkilemediği ve hacimlerinin ihmal edilebilir olduğu varsayımına dayanır. Gerçek gazlar, yüksek sıcaklık ve düşük basınç altında ideal gaz davranışına daha yakın hale gelir. Yüksek Sıcaklıkta Gaz Davranışı Yüksek sıcaklıklarda ideal gazların davranışları, belirli bazı fiziksel yasalarla açıklanır. Bu bağlamda, aşağıdaki noktalar dikkate alınır:
İdeal Gaz Yasası İdeal gazların davranışını matematiksel olarak tanımlayan ideal gaz yasası şu şekildedir: \[ PV = nRT \] Burada; - \( P \): Gazın basıncı - \( V \): Gazın hacmi - \( n \): Gazın mol sayısı - \( R \): Gaz sabiti - \( T \): Gazın mutlak sıcaklığı Yüksek sıcaklıklarda, gazın davranışlarını bu yasa ile analiz etmek mümkündür. Ancak basınçların çok yüksek ve sıcaklıkların aşırı derecede yükseldiği durumlarda, gazların davranışları ideal koşullardan sapabilir. Sonuç Sonuç olarak, ideal gazlar yüksek sıcaklıklarda arttırılmış moleküler hareket, artan basınç ve hacim değişimleri gibi özellikler sergiler. Ancak, bu durumlar yalnızca ideal gaz varsayımlarının doğru olduğu şartlar altında geçerlidir. Gerçek gazların davranışları, özellikle çok yüksek sıcaklıklarda, ideal gaz yasasından sapabilir. Bu nedenle, mühendislik uygulamalarında ve bilimsel çalışmalarda gaz davranışlarını daha doğru bir şekilde tahmin etmek için gerçek gaz dengelerini ve teorilerini kullanmak önemlidir. |
İlk soruyu siz sormak istermisiniz?