
10 Sınıf Gaz Basıncı
Gaz basıncı, gazların fiziksel özelliklerini anlamak için kritik bir kavramdır. Moleküllerin yüzeylere çarpması sonucu oluşan bu basınç, gazların davranışını ve etkileşimlerini belirler. Bu yazıda, gaz basıncı, yasaları ve uygulamaları detaylı bir şekilde ele alınacaktır.
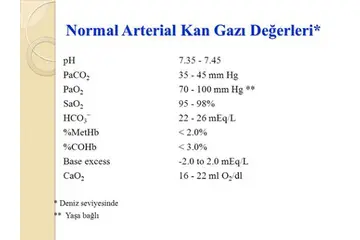
Gaz basıncı, gazların fiziksel özelliklerini anlamak için temel bir kavramdır. Bu kavram, gazların davranışlarını ve etkileşimlerini anlamak için önemlidir. Gaz basıncı, bir gazın birim alana uyguladığı kuvvet olarak tanımlanır ve genellikle atmosfer (atm), pascal (Pa) veya milimetre cıva (mmHg) gibi birimlerle ifade edilir. Bu makalede, 10. sınıf seviyesinde gaz basıncı konusunu ele alacak, temel kavramları, yasaları ve uygulamaları açıklayacağız.Gaz Basıncı Nedir?Gaz basıncı, gaz moleküllerinin bir yüzeye çarpması sonucu oluşan kuvvetin, o yüzeyin alanına bölünmesiyle elde edilen değerdir. Gazlar, serbestçe hareket eden moleküllerden oluştuğu için, moleküllerin çarpma sayısı ve hızı, gaz basıncını etkileyen önemli faktörlerdir.
Gaz Basıncı Yasaları Gaz basıncı ile ilgili birkaç temel yasa bulunmaktadır. Bu yasalar, gazların davranışlarını matematiksel olarak ifade eden önemli ilişkilere dayanır.
Gaz Basıncının Ölçülmesi Gaz basıncını ölçmek için çeşitli aletler kullanılmaktadır. Bu aletler, gaz basıncını doğru bir şekilde belirlemek için tasarlanmıştır.
Gaz Basıncının Uygulamaları Gaz basıncı, birçok alanda önemli uygulamalara sahiptir. Bu uygulamalar, bilimsel araştırmalardan endüstriyel kullanımlara kadar geniş bir yelpazeyi kapsamaktadır.
Sonuç Gaz basıncı, gazların fiziksel özelliklerini ve davranışlarını anlamak için temel bir kavramdır. Boyle, Charles ve Avogadro yasaları gibi temel prensipler, gazların basıncı ile hacmi, sıcaklığı ve molekül sayısı arasındaki ilişkileri açıklamaktadır. Gaz basıncının doğru bir şekilde ölçülmesi, çeşitli endüstriyel ve bilimsel uygulamalar için hayati önem taşır. Bu nedenle, gaz basıncı ile ilgili temel bilgilerin öğrenilmesi, hem akademik hem de pratik açıdan kritik bir öneme sahiptir. |




































Gaz moleküllerinin sürekli olarak kabın iç yüzeyine çarparak basınç oluşturduğunu söyleniyor. Peki, bu çarpmaların şiddeti tam olarak nasıl belirleniyor ve hangi durumlarda artıyor?
Sevgili Uluçkan,
Gaz moleküllerinin kabın iç yüzeyine çarparak oluşturduğu basıncın şiddeti, moleküllerin hızına ve sayısına bağlıdır. Moleküllerin hızları sıcaklıkla doğrudan ilişkilidir; sıcaklık arttıkça moleküllerin kinetik enerjisi ve dolayısıyla çarpma şiddeti artar. Aynı şekilde, gazın yoğunluğu arttığında, yani birim hacimdeki molekül sayısı arttığında, çarpma sıklığı ve basınç da artar. Bu nedenle, sıcaklık veya gaz miktarı arttığında, gazın oluşturduğu basınç da artar.
Saygılarımla.