Gazlar konusunda hangi formülleri bilmemiz gerekiyor?
Gazlar, belirli bir şekli olmayan ve kapladıkları alanı dolduran maddelerdir. Bu yazıda, gazların temel özelliklerini, ideal gaz yasası ve Boyle, Charles gibi önemli yasalarla birlikte inceleyerek, gazların davranışını anlamak için gerekli bilgileri sunuyoruz.
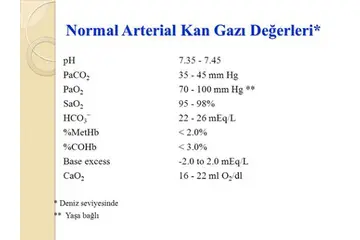
Gazlar ve Özellikleri Gazlar, belirli bir şekli olmayan ve kapladıkları alanı tamamen dolduran maddelerdir. Gazların davranışını anlamak için bazı temel formüller ve yasalar bulunmaktadır. Aşağıda gazlar konusunda bilmeniz gereken önemli formüller yer almaktadır. 1. Ideal Gaz Yasası Ideal Gaz Yasası, bir gazın basıncı (P), hacmi (V), sıcaklığı (T) ve mol sayısı (n) arasındaki ilişkiyi açıklar. Formülü şöyledir:
Burada;
2. Boyle Yasası Boyle Yasası, sabit sıcaklıkta bir gazın basıncı ile hacmi arasındaki ters orantıyı ifade eder. Formülü şöyledir:
3. Charles Yasası Charles Yasası, sabit basınç altında bir gazın hacminin sıcaklıkla doğrudan orantılı olduğunu belirtir. Formülü şöyledir:
4. Avogadro Yasası Avogadro Yasası, belirli bir sıcaklık ve basınç altında, eşit hacimlerdeki gazların aynı mol sayısına sahip olduğunu belirtir. Formülü şöyledir:
5. Dalton'un Kısmi Basınçlar Yasası Dalton'un Kısmi Basınçlar Yasası, bir gaz karışımındaki her bir gazın, toplam basınca katkısını belirtir. Formülü şöyledir:
6. Gay-Lussac Yasası Gay-Lussac Yasası, sabit hacimde bir gazın basıncının sıcaklıkla orantılı olduğunu belirtir. Formülü şöyledir:
7. Graham'ın Difüzyon Yasası Graham'ın difüzyon yasası, gazların difüzyon hızlarının, mol kütlelerinin karekökleri ile ters orantılı olduğunu belirtir. Formülü şöyledir:
Sonuç Gazların davranışını anlamak ve hesaplamalar yapmak için yukarıda belirtilen formüller kritik öneme sahiptir. Bu yasalar, gazların fiziksel özelliklerini anlamanızı ve laboratuvar çalışmaları gibi çeşitli uygulamalarda kullanmanızı sağlar. Her bir formül, gazların çeşitli koşullarda nasıl tepki verdiğini incelemek için kullanabilir. |
İlk soruyu siz sormak istermisiniz?